[nextpage title=”Schrankenstörung” img=”249452″]
Probleme im Betriebskreislauf.
Schrankenstörung?
Die Blut-Hirn-Schranke (Blood-Brain-Barrier, BBB) ist eine festere Schranke im menschlichen Gehirn, als jene, die in anderen Organen vorkommen. Sie schützt das Gehirn nicht nur vor Infektionen, sondern auch vor Faktoren des körpereigenen Immunsystems, verhindert aber auch, dass viele Medikamnte ins Zentrale Nervensystem (ZNS) übertreten und dort eine – gewünschte oder ungewünschte – Wirkung entfalten. Sie ist jedoch kein statischer Schutzwall, da sie dauerhafter Veränderung unterworfen ist. Unter anderem können Schlaganfälle, Traumata, Infektionen und Entzündungen zu einer Veränderung innerhalb der BBB führen.
 Fabian Schwarze | StudentenPACK.
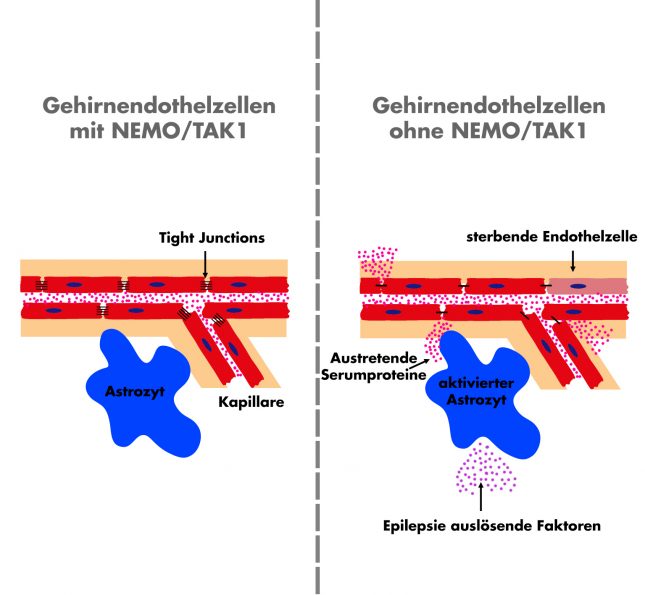
Fabian Schwarze | StudentenPACK. Der Effekt von endothelialem NEMO auf die Blut-Hirn-Schranke.
Diese Art der Öffnung und die Funktionsweise der beteiligten Zellen der BBB versuchen Jan Wenzel und ein Team aus 5-6 Personen – darunter Doktoranden, Bachelor- und Masterstudenten aus Fächern von MLS und Medizin bis hin zur Psychologie – zu verstehen und zu nutzen. Dieses Verständnis könnte einen wichtigen Schritt in der medikamentösen Psychologie und Psychiatrie ausmachen, da so möglicherweise in Zukunft Medikamente gezielt an der BBB vorbei geschleust werden können und an ihren Wirkungsort transportiert werden. Bei ZNS-Infektionen, Depressionen, Epilepsie, Demenz und vielen weiteren neurologischen Erkrankungen kann also eine genauere Therapie erreicht werden.
Im „Center for Brain Behavior and Metabolism“ (CBBM) werden hierzu Krankheitsmodelle an künstlichen BBBs simuliert und erforscht. Dazu werden die hauptsächlich für die BBB notwendigen Endothelzellen betrachtet. Diese bilden die Innenschicht der Blutgefäßen und stehen so in direkter Verbindung zu im Blut gelösten Stoffen (siehe Bild). Verbunden sind die Endothelzellen durch sogenannte tight-junctions. Diese füllen die Zellzwischenräume und bilden so eine für diese Stoffe undurchdringliche Barriere. Ist die Bildung von tight-junctions gestört oder sind diese beschädigt, können Stoffe aus dem Blut ungehindert in das Gehirn vordringen und so eine Vielzahl gefährlicher Erkrankungen auslösen. Für Moleküle, die im Gehirn benötigt werden – vor allem Glucose – gibt es spezielle Transportproteine an den Endothelzellen. Die Regulation der tight-junctions gehört also zu den wichtigsten Anwendungsgebieten der Forschung, wobei Zell-Zell- und Zell-Blut-Kontakte die wichtigste Rolle spielen.
Diese Erkenntnis stammt aus der Forschung an NEMO/TAK1 (benannt nach einer französischen Comicfigur), einem Gen, welches ausschlaggebend für die Erhaltung von Endothelzellen ist. Ist dieses Gen durch Mutation oder ähnliches gestört, treten Veränderungen in der BBB auf und Stofftransporte durch die BBB können ermöglicht werden. Diese Krankheit nennt sich Incontinentia pigmenti und ist ein häufiger Auslöser von Epilepsie und Hautirritationen. Dabei werden Endothelzellen zerstört und ein ungehinderter Fluss durch die BBB ist möglich. Einige Stoffe, wie zum Beispiel Albumin – das häufigste Protein im Blut -, die normalerweise das Gehirn nicht erreichen, können spezifische Helferzellen (Astrozyten) im Gehirn aktivieren, welche dann Epilepsie-auslösende Faktoren abgeben können. Wie kann so eine Schrankenstörung also verhindert oder behandelt werden? Hierzu gibt es einige vielversprechende Angriffspunkte der BBB-Forschung:
Eine solche Mutation könnte in Zukunft zum Beispiel durch spezifische Gentherapien in ihre „normale“, also gesunde Form übertragen werden. Dazu werden Viren (Vektoren) verwendet, die spezifische Genelemente austauschen, entfernen oder variieren können. In diesem Fall wurde ein viraler Vektor entwickelt, der nicht alle Körperzellen angreift, sondern spezifisch auf Endothelzellen „eingestellt“ ist. Dieser soll ein gesundes NEMO-Gen in die Zellen einbringen und damit einer Schädigung zuvorkommen. Dies ist jedoch Zukunftsmusik, da weder die Gentherapie noch die Forschung an der BBB weit genug vorangeschritten sind, um Versuche am Menschen zu ermöglichen.
Eines der Ziele der Forschung an der BBB ist das Verhindern und das Verständnis von Schädigungen an den Endothelzellen und den dazugehörigen tight-junctions, welche sowohl durch genetische, als auch durch traumatische Faktoren ausgelöst werden können. Die Frage ist in diesem Fall, inwieweit eine BBB-Störung eine Grunderkrankung verschlimmern kann. So kann eine Kopfverletzung die Durchlässigkeit der BBB beeinflussen, was zu diversen neuronalen Symptomen führen kann.
Doch wie kam man darauf gerade an den Endothelzellen zu forschen? Als eine BBB-Störung erstmals beschrieben wurde, war der Aufbau der Blut-Hirn-Schranke bereits bekannt.Bei der Erforschung, welcher Teilaspekt der Schranke am leichtesten zu beschädigen war, kam man auf die die tight-junctions. Die wichtigste Erkenntnis der Forschung ist in diesem Fall die Realisation, dass viele neurologischen Symptome auf einer Störung der BBB beruhen und keine Nervenschädigung zugrunde liegt.
Auch die Alzheimer-Demenz könnte durch einen ähnlichen Mechanismus entstehen. In diesem Fall stehen die Gefäßveränderungen am Anfang und nicht die Nervenzellen. Da die Alzheimer-Demenz noch nicht gut genug erforscht ist, könnte die vaskuläre Alzheimer-Hypothese durch die Erkenntnisse der BBB-Forschung irgendwann einmal vielleicht neue Therapieoptionen ermöglichen.
Zum Teil ist bereits der Status erreicht, dass Tiermodelle verwendet werden können, um ZNS-Medikamente in Verbindung mit Blutfluss und einem „Überangebot“ von Zellen zu testen. Bisher werden diese wie auch die Vektoren nicht nur von den Zielzellen, sondern auch von anderen aufgenommen, sodass noch Modifikationen notwendig sind. Zahlreiche Nebenwirkungen müssen unter Kontrolle gebracht werden, wobei der Schritt von der Zellkultur zum Tier genauso groß ist wie vom Tier zum Menschen.
Klicke auf den nächsten Text um über weitere aktuelle Forschungsthemen an der Uni Lübeck zu lesen.
[/nextpage]
[nextpage title=”Mäusejetlag” img=”249454″]
Chronophysiologie hat leider nichts mit Zeitreisen zu tun.
Mäuse mit Jetlag?
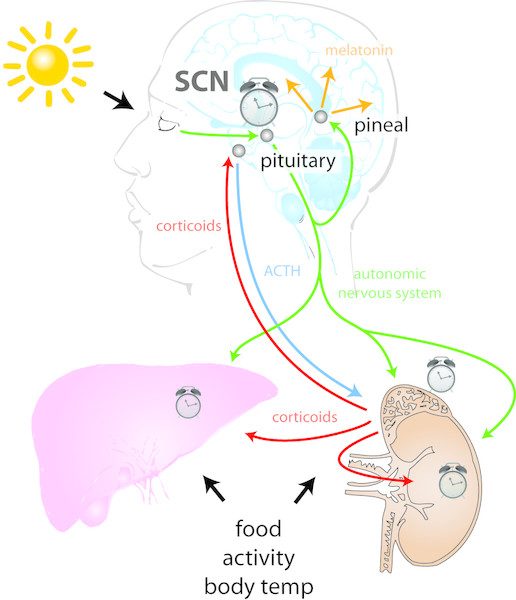
Woher weiß unser Körper, wann Tag und wann Nacht ist? Warum nehmen Menschen im Schichtdienst leichter zu? Warum hat der menschliche Körper so viele Probleme mit der Umstellung auf andere Zeitzonen? Mit diesen und vielen weiteren Fragen beschäftigt sich die Chronophysiologie und demnach auch Dr. Henrik Oster im CBBM. Störungen der „inneren Uhr“ betreffen mehr als ein Drittel der westlichen Bevölkerung. Aber wie funktioniert eine solche Uhr?
Praktisch jede Zelle besitzt eine eigene Uhr und so gut wie jeder Prozess im menschlichen Körper ist Tagesformabhängig. Zusätzlich gibt es eine übergeordnete „Uhr“ im Hypothalamus, die mit dem Hell-Dunkel-Zyklus synchronisiert wird. Aktuelle Erkenntnisse besagen: Jede Zelle misst bestimmte Zeitabschnitte durch sogenannte transkriptionelle-translatorische Rückkopplungsschleifen. Zwei Transkriptionsfaktoren aktivieren spezifische Gengruppen, welche durch ihre eigene Translation ihre Biosynthese beenden. Diese dabei entstandenen Inhibitoren werden über die Nacht hinweg abgebaut, sodass der Prozess am nächsten Morgen erneut durchgeführt werden kann. Dabei ist es möglich die „Uhrzeit“ des einzelnen Menschen anhand der exprimierten Gene zu bestimmen. Dies wird durch das autonome Nervensystem und die gezielte Ausschüttung von Cortisol in jeder Zelle „gleichgeschaltet“.
Ein Versuchsaufbau in der AG Chronophysiologie befasst sich mit einem häufigen Problem von Flugreisenden – dem Jetlag. Hierfür werden Mäuse mitsamt ihren Käfigen einem sich stetig ändernden Tag-Nacht-Rhythmus ausgesetzt. Dabei wird ihre Aktivität anhand der Laufradnutzung gemessen. Nach einer abrupten Änderung des Rhythmus wird bis zu eine Woche (circa 1 Stunde pro Tag) gebraucht, um die übliche Laufradnutzung zu erreichen. Wird dabei der Cortisolspiegel der Mäuse künstlich erhöht, können die „Zelluhren“ eine frühere Anpassung an die veränderten Rhythmen durchführen. Dadurch die Anpassungszeit der Mäuse halbiert werden. Im menschlichen Versuch wird bereits versucht, ähnliche Effekte zu erzielen, jedoch aufgrund der verringerten Cortisol-Menge im Versuch noch ohne Effekt.
Im menschlichen Beispiel zeigt die Chronophysiologie nicht nur die Zusammenhänge zwischen Gedächtnisfunktionen und Störungen der inneren Uhr, sondern auch ein höheres Risiko von Nacht- und Schichtarbeitern (auch Flugpersonal) an bestimmten Leiden (Diabetes, Brustkrebs, Herzinfarkt, Depressionen) zu erkranken. Hier zeigt sich die Relevanz der Forschung für die Arbeitsmedizin. Sollte also eine Lösung gefunden werden, die „inneren Uhren“ beispielsweise mithilfe der Anpassung selbiger durch Cortisol zu beeinflussen, könnte diesen Berufsrisiken vorgebeugt werden. Da eine Nachtschicht in absehbarer Zeit nicht abgeschafft werden wird und nicht abgeschafft werden kann, könnte wenigstens das Risiko für Menschen, die in diesen Berufen arbeiten, verringert und die Schäden behandelt werden.
Eine weitere Erkenntnis ist die Einteilung von Altersgruppen zu bestimmten Chronotypen – das heißt Menschen mit verschiedenen Wach-Schlaf-Rhythmen. Während Kinder bis zur Pubertät noch dem frühen Chronotyp angehören, sind Teenager und junge Erwachsene einem späteren Chronotyp zuzuordnen, welcher ungefähr Mitte Zwanzig (22-25) zurück in die frühe Form verschoben wird. Dies bedeutet jedoch, dass z.B. der Start, der Schule (zum Teil auch der Universität) vor 8 Uhr gegen die gesunden Chronotypen der Schüler wirkt. Ein Schulstart um 9 oder 10 Uhr wäre in diesem Sinne der Idealfall für effektives Lernen. Da jedoch die Lehrer (und Professoren) wieder dem späten Chronotyp angehören besteht in diesem Fall ein Interessenkonflikt. Ein Ergebnis der chronophysiologischen Arbeiten ist aber, dass Klausuren in den meisten Fällen nicht mehr in die ersten Schulstunden gelegt werden. Diese fielen in Vergleichen deutlich schlechter aus (ungefähr eine volle Note), als jene, welche später durchgeführt wurden. Auch die universitären Vorlesungen sollten dem späten Chronotyp zugeordnet werden.
Auch eine Verhaltensanleitung kann aus dieser Forschung gezogen werden. So können durch die Erkenntnis und die Einteilung von Personen in verschiedene Chronotypen die „effektivsten“ Zeiten für Essen, Schlafen, Sport, Lernen usw. gefunden werden. Dies wird leider zu häufig in den „unwissenschaftlichen“ Bereich gebracht. Die meisten Dinge, die darüber zu lesen sind, sind nicht wissenschaftlich fundiert. Doch der Trend geht eindeutig in diese Richtung.
Uhren im ZNS bestimmen, wann wir müde und wach sind. Aber auch unser Umgang mit Schlafentzug hängt von der Funktion der Uhrengene ab. Andersherum kann Schlaf als Zeitsignal dienen für die Regulation molekularer Uhrwerke. Schlaf und Uhr zusammen regulieren zahlreiche physiologische Prozesse – besonders im Zusammenhang mit der Nahrungsaufnahme und Verwertung
Ein zukünftiger Bereich in der chronophysiologischen Forschung sollen die Einflüsse auf das Stresssystem und die Verhaltensregulation, insbesondere das Essverhalten ausmachen. Warum wird abends gerne noch fettige oder zuckerhaltige Nahrung zu sich genommen, obwohl man eigentlich satt ist? Welche Auswirkungen hat ein gutes rhythmisches System auf den Stress oder das Verhalten? Sowohl das (hedonische) Appetitssystem, als auch das Stresssystem sind rhythmisch gesteuert. Ein gestörter Rhythmus hat in diesem Fall Auswirkungen auf die Entwicklung von Adipositas oder metabolischen Erkrankungen. In Mäusen ist dies sehr einfach zu zeigen: Schaltet man die „innere Uhr“ der Mäuse aus, nehmen diese rapid zu. Fettabbauende Enzyme sind dort durch die Uhrengene aktiviert. Sind diese inaktiv, kann das meiste Fett nicht mehr abgebaut werden, sondern wird im Körper eingelagert und der dadurch resultierende Verlust der Energie aus dem Fett muss dem Körper wieder zugeführt werden. Teile der zugeführten Nahrung werden sogar wieder als Fett eingelagert.
Diese Probleme basieren natürlich auch auf der hochenergiereichen Nahrung und der präzisen Zeitplanung und tauchen daher meist in wohlhabenden Ländern auf.
Klicke auf den nächsten Text um über weitere aktuelle Forschungsthemen an der Uni Lübeck zu lesen.
[/nextpage]
[nextpage title=”Diabetes” img=”249451″]
Epigenetik oder doch Ernährung?
Wer ist schuld an Diabetes?
Die Entstehung des Typ-2-Diabetes – einer mit der Zeit auftretenden Insulinresistenz – ist weitestgehend unbekannt. 90% der Diabetiker sind Typ-2-Diabetiker, die früher als Altersdiabeter bezeichnet wurden. Heutzutage sind jedoch auch schon Kinder von dieser Krankheit betroffen. Auch eine epigenetische Betrachtung der Entstehung der Insulinresistenz und Adipositas ist notwendig. Mit diesen und weiteren Fragen beschäftigt sich die Ernährungswissenschaftlerin Dr. Henriette Kirchner.
 Fabian Schwarze | StudentenPACK.
Fabian Schwarze | StudentenPACK. Die epigenetische Forschung ist in den neuen Laborräumen des CBBM angesiedelt.
Epigenetik ist die Betrachtung von Methylierungen, Histonen und non-coding-RNAs – also den „Verpackungsmustern“ – der DNA. Diese sind nicht nur vererbbar, sondern auch durch Umwelteinflüsse beeinflussbar. Der Fakt, dass eineiige Zwillinge sich unterschiedlich entwickeln, wenn sie an verschiedenen Orten aufwachsen oder auch nur andere Gewohnheiten haben, ist auf epigenetische Faktoren zurückzuführen. Dabei spielen Toxine, die Luftqualität und verschiedene Aktivitäten eine große Rolle. Auch Ess- und Schlafmuster haben eine Auswirkung auf die DNA. In der Forensik kann die Epigenetik eingesetzt werden, um sowohl Alter der Person, als auch den Zelltyp zu bestimmen.
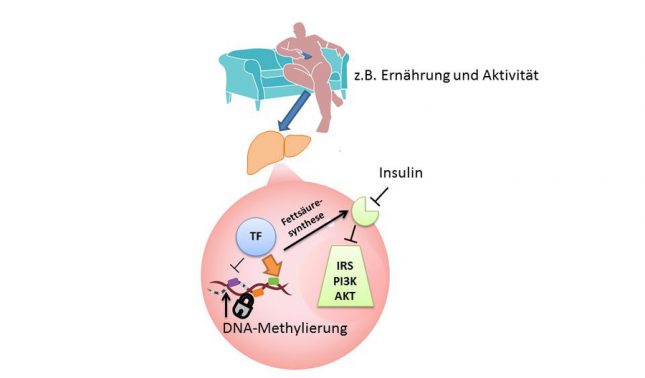
Sowohl Adipositas als auch Typ-2-Diabetes können durch Umweltfaktoren ausgelöst werden. In beiden Fällen sind die Entstehungsursachen nicht vollständig entschlüsselt. Diabetes und Adipositas gehen aber häufig Hand in Hand. Viele an Adipositas leidende Personen bilden mit der Zeit einen Typ-2-Diabetes aus, doch auch normalgewichtige Personen können eine Insulinresistenz entwickeln. Dieses willkürlich erscheinende Auftreten ist zu großen Teilen genetisch bedingt. Dabei gibt es nicht nur ein Gen, welches die Krankheit auslöst, sondern ein weitgehend unbekanntes System von Genen in einem großen Zusammenspiel. Aber durch genetische Faktoren allein lässt sich die Krankheit nicht erklären. Hier kommt die Epigenetik ins Spiel.
In Zukunft sollen Medikamente entwickelt werden, die die DNA-Methylierung gezielt beeinflussen sollen, um möglicherweise Typ-2-Diabetes und Adipositas auslösende Faktoren in einen gesunden Status zu überführen. Dafür werden sogenannte DNA-Methyltransferasehemmer eingesetzt. Diese stammen aus der Krebsforschung und sind sehr unspezifisch. Sie treffen in einer Holzhammermethode alle Gene und sind daher noch nicht gezielt einsetzbar. Das Ziel ist in diesem Fall die Methylierungsprävention an den im methylierten Status Diabetes auslösenden Genen. Dies ist eine um einiges präzisere Aufgabe als die der Gentherapie, da in diesem Fall keine ganzen Gene, sondern einzelne Basenpaare ausgetauscht werden müssen.
Überwiegend wird aktuell an menschlichen Blut-, Leber-, und Fettproben gearbeitet – hauptsächlich von an Adipositas oder an Typ-2-Diabetes leidenden Personen. Dabei werden Vergleiche angestellt, die die Verbindung zwischen den Krankheiten aufdecken könnten. Es ist jedoch besonders schwierig, an Fett- und Leberproben von gesunden Normalgewichtigen zu gelangen, da meist nur bei Operationen gewonnen werden können. An solchen Proben wird dann die Methylierung gemessen. Dies geschieht indem die unmethylierten Cytosin-Basen mit Bisulfiten in Uracil umgewandelt werden. Dies kann dann mithilfe einer DNA-Sequenzierung quantifiziert werden. Man kann also sowohl sagen, wie groß der Anteil der methylierten Basen ist, als auch die spezifischen methylierten Basen bestimmen.
Es konnte bereits gezeigt werden, dass in den Inselzellen des Pankreas, in Leberzellen, in subkutanen Fettgewebszellen und im Blut von Übergewichtigen eine andere DNA-Methylierung vorliegt. Diese müssen jetzt funktionell charakterisiert werden. An Mausmodellen könnte dann herausgefunden werden, welche Faktoren genau diese speziellen Methylierungsmuster auslösen – liegt dies an der Nahrung, der geringen körperlichen Aktivität oder ist dies tatsächlich ein vererbter Faktor. In den Humanproben liegt in diesem Fall nur eine Momentaufnahme vor. Dort ist nicht festzustellen, was nun die Ursache oder die Konsequenz ist.
Bis jetzt konnten im Vergleich von Leberproben übergewichtiger Menschen, übergewichtiger Diabetiker und normalgewichtiger Probanden einige Kandidatengene bestimmt werden, die für die Entwicklung des Typ-2-Diabetes ausschlaggebend sein könnten. Diese müssen jetzt genauer charakterisiert und validiert werden.
Ziel der Forschung ist zwar auch die Behandlung von Typ-2-Diabetes, mehr jedoch die Prävention von Adipositas und dem damit verbundenen Diabetes durch Änderung der Lebensweise der betroffenen Personen. Mit der Forschung an Übergewicht und Diabetes wird an den großen gesundheitlichen Problemen unserer Zeit gearbeitet. Schon heute sind auf der Welt mehr Menschen übergewichtig als untergewichtig. Selbst in Dritte-Welt-Ländern und im arabischen Raum steigt der Trend zum Übergewicht stetig an. In Europa ist Deutschland mittlerweile zum „dicksten Land“ aufgestiegen. Ist diese Arbeit in diesem Fall nicht eine Arbeit an den Problemen, die sich die Menschen selbst auferlegen?
Nach der zu untersuchenden Hypothese verändern Lifestyle-Faktoren die DNA-Methylierung in der Leber.
Die Epigenetik zeigt in diesem Fall deutlich, dass die Probleme zu großen Teilen nicht vererbt werden, sondern durch eigene Handlungen und persönliche Einflüsse, Auswirkungen auf das Erbgut haben können. Dabei ist jedoch jeder Mensch nur bis zu einem gewissen Punkt selbst verantwortlich. Ab diesem Punkt „schaltet“ das Gehirn um und an Adipositas leidende Menschen verspüren tatsächlich einen Hunger und einen stark verminderten Bewegungsdrang.
Die Ernährungswissenschaften mit ihrem Schwerpunkt auf der Biochemie des Metabolismus sind ein wichtiger und aufstrebender Zweig der aktuellen medizinischen Forschung. Ab dem Wintersemester wird Dr. Kirchner im Rahmen des Studiengangs der Medizinischen Ernährungswissenschaften den Kurs Ernährungsphysiologie mitunterrichten.
Klicke auf den nächsten Text um über weitere aktuelle Forschungsthemen an der Uni Lübeck zu lesen.
[/nextpage]








 Rubrik
Rubrik Themen
Themen Der Autor
Der Autor  Datum
Datum
 Ausgabe November 2016
Ausgabe November 2016
 Mundpropaganda
Mundpropaganda Diskussion
Diskussion  Sonderseiten
Sonderseiten